1. INTRODUCTION
In a recent survey conducted from 2018 to 2019, in the 2,805 wooden heritage structures, 486 cases of subterranean termite infestations were discovered, of which 30% were ongoing. This finding indicates the continuous nationwide damage to the outdoor wooden heritage structures by subterranean termites (Im et al., 2021). The results from previous studies have confirmed that subterranean termites belonging to Reticulitermes spp. inflict damage to various wooden structures in Korea (Kim et al., 2010; Lee and Jeong, 2004; Chung et al., 2015; Lee et al., 2015). Owing to these characteristics of the subterranean termites, there has been an increase in the structural damage to the wooden heritage structures, and the Risk Management Division of Animal and Plant Quarantine Agency has selected 28 termite species with a high risk of damage once domestic termite invasion and settlement occurs (Korea Forest Service, 2016). Additionally, the National Research Institute of Cultural Heritage under the Cultural Heritage Administration and the 23 Cultural Heritage Care Project groups in 17 cities/provinces are regularly monitoring the termite infestations in wooden heritage structures nationwide. These organizations are monitoring the subterranean termites through many methods, such as termite detection dogs, microwave detection devices, ultrasonic detection devices, video microscope, installation of wood specimens, and investigate trace of damages through visual observation (Cultural Heritage Care Support Project, 2019; Kim et al., 2019; Son and Lee, 2008).
However, these domestically employed termite monitoring methods have limitations in monitoring and controlling the size of the colonies and the extent of the activity area since the Reticulitermes speratus colonies that invade via tunneling under the ground near the targeted wooden structure cannot be determined using such measures. To solve these problems, in the late 1980s, inspection via monitoring stations was conducted overseas to detect the foraging territory to control the termite colonies (Su et al., 1986; Grace, 1989, 1990; Thorne et al., 1996; Tsunoda et al., 1998, 1999) and various colored dye markers were applied to the collected specimens. In the early stages of dye-marker research (early 1980s), the marking effect of Sudan Red 7B based on concentration conditions was evaluated on majorly affecting species such as Coptotermes formosanus and Reticulitermes flavipes (Su et al., 1983, 1988; Grace and Abdallay, 1989). Additionally, the application of several other dye markers, such as Nile Blue A (Su et al., 1993; Grace, 1989, 1990; Forschler and Townsend, 1996; Thorne et al., 1996) and Neutral Red (Evans, 2000; Nobre et al., 2007) to Coptotermes formosanus and Reticulitermes flavipes have been studied since the 1990s. Moreover, Tsunoda et al. (1998, 1999) applied 0.05% Nile Blue A to R. speratus to monitor the territory of the outdoor colony.
Meanwhile, to review the dye markers suitable for monitoring subterranean termites in Korea, Kim et al. (2014) investigated the survival rate, transfer effect, and appropriate concentrations of Nile Blue A on R. speratus. Furthermore, Kim et al. (2020) investigated the applicability of Nile Blue A on R. speratus. The key issue is that it lowered the overall survival rate because the restricted study environment was exposed to the atmosphere, which is different from the actual living conditions of the subterranean termite. Im and Han (2020) used Sudan Red 7B on R. speratus to devise an assessment method that considered the actual habitat environment of the subterranean termite. However, even at the highest concentration of Sudan Red 7B, the dye persistence was shown in R. speratus within 2 weeks, indicating that it was not suitable for dyeing for subterranean termite monitoring.
Therefore, in this study, the type and appropriate concentration of a dye marker to measure the extent of R. speratus territory was investigated using the assessment method established by Im and Han (2020). The range of the dye markers for evaluating the appropriate concentration was between 0.1% and 0.5%. For the dye-marker evaluation, Nile Blue A, which has been investigated on R. speratus previously, was compared with Neutral Red, a new marker for R. speratus. Also, when the extent of the territory of the subterranean termite invading the wooden structures is monitored using the dye markers, it appears that a certain amount of time is required for the released individuals to spread evenly to all areas within the colony. Therefore, an indoor foraging arena was produced, and two dye markers were applied to 1,000 individuals (Nile Blue A: 500 unit and Neutral Red: 500 unit) to observe the range of the spread area and the mixing patterns of the released individuals over time.
2. MATERIALS and METHODS
The termite-infested logs were collected from the forests in Goun-dong, Sejong City and Cheongju City, Chungcheongbuk-do and stored in containers in the laboratory. The study object separation method was modified from the established procedures of Judd and Fasnacht (2007) and Tamashiro (1973) as follows: Right before the start of the experiment, corrugated cardboard was placed in a storage container for a certain amount of time for the termites to move over to the cardboard so that they were separated without any decomposition of logs inside the containers.
Mitochondrial DNA (mtDNA) of the collected subterranean termites was extracted using DNeasy Blood & Tissue Kit (SolGent Co., Ltd. Korea). Polymerase Chain Reaction (PCR) was performed using Takara PCR Thermal Cycler Dice TP600 (Takara Bio Inc., Japan) and the PCR primer sets used in this study were LCO-1490 and HCO-2198. To obtain the cytochrome oxidase I (COI) barcode sequence of the collected subterranean termite mtDNA, 2x Uh-taq PCR Pre-Mix (SolGent Co., Ltd., Korea) was used. COI sequence (658bp) was confirmed with GenBank and BOLD system (barcoded of the Life Data System). According to the results, the termites used in this study were identified as R. speratus.
Based on previous studies abroad, Nile Blue A (CAS Number: 3625-57-8, Sigma, St. Louis, Mo. USA) and Neutral Red (CAS Number: 553-24-2, Acros Organics, New Jersey, USA) were used (Nobre et al., 2007; Evans, 2000, 2006; Kim et al., 2020). The sample containing the marking reagents was produced according to the method of Im and Han (2020). Dye-marker concentration conditions for each type of dye in R. speratus were prepared by diluting the dye to 0.1%, 0.2%, and 0.5% according to the weight ratio (wt/wt), as reported in previous studies related to dye-marker concentration on C. acinaciformis, C. lacteus, and R. grassei (Nobre et al., 2007; Evans, 2000).
The trial arena for marking was prepared as follows: 35g of substrate prepared by mixing washed silica sand and distilled water in a ratio of 10:1 (wt/wt) was placed in a 90 mm Petri dish, and the sample containing the marking reagents was placed on it. Subsequently, 400 workers were added to the arena to be exposed under forced feeding (no-choice) conditions for 5 days. These termites were stained according to each concentration condition of the dye markers. Each experiment was conducted three times, five repetitions were performed for each condition, and the final value of the experiment was averaged from a total of 15 replicates.
Feeding amounts of the filter paper for 5 days in line with each concentration of a type of dye were measured. After 5 days of the feeding period, feed samples were collected, dried to a constant weight at 60℃ in a dryer, and the weights were measured. The feeding amounts for the concentration conditions of each dye type were compared to investigate the feeding activities according to the concentration increase.
Survival rate per dye marker type and concentration condition were investigated. In this method, 25 g of silica sand containing moisture in the same condition described in 2.2 was placed in a 55 mm Petri dish. In terms of the feeding source, 5 g of sawdust diet containing a mixture of sawdust and cellulose powder, etc., was prepared according to Matsuura and Nishida (2001) and placed on top of the silica sand. Fifty conditionally marked workers, as described in 2.2, were introduced. The container was covered with the lid and sealed with Parafilm to prevent evaporation of the moisture. Aeration and the replenishment of the sawdust diet were performed weekly. The number of replicates was 20 for each concentration condition, and 5 replicates were randomly selected each week to check the survival rates for 4 weeks. Additionally, to evaluate the marking persistence of each condition, the same study arena and marking methods were prepared as described in 2.2 for 200 workers to be deployed in each condition. For the feeding source, 5 g of sawdust diet was provided per week. Depending on the time progress and feeding activity, the marking persistence was measured using a stereoscopic microscope (Nicon, JSMZ800N, JPN). The shoot was conducted right after the marking at week 4 and week 8 for each condition by collecting the workers for each concentration condition.
Marking reagent transfer between the marked and unmarked individuals by Trophallaxis was investigated. The concentration of both the dye markers, Nile Blue A and Neutral Red, was 0.2% for the marked individual. Therefore, 30 marked workers, 30 unmarked workers, and 3 unmarked soldiers were placed in a 55 mm Petri dish under the same survival assessment condition as 2.3. Sawdust diet was provided as the feeding source. Petri-dish aeration and sawdust diet feeding were provided once every week for 21 days, and simultaneously, the number of marked and unmarked workers was estimated and the marking transfer-effect trends of the soldiers were observed.
To confirm the applicability of the markers for investigating the extent of the activity area of the subterranean termite colony infesting the wooden structures and the area of the wooden heritage site, the foraging arena was produced to measure the spread area coverage over time of the marked individual. The arena was composed of four pathways for each direction based on the main nest, and each tube was about 5 m long. For each direction, four tubes were connected to make a 20 m long pathway, and the total length of both sides was 40 m, with the main nest in the middle (Fig. 1, 2).
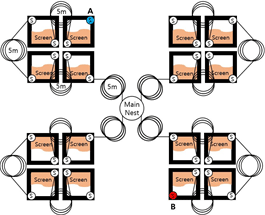

The main nest was a container of 100 mm diameter and 110 mm height containing 250 g of sawdust diet as a constant feeding source for the termite colony. Furthermore, for up to a height of 10 mm, 3.5% agar was poured on the top to suppress microbial germination on the sawdust diet surface to the best possible extent.
The shelter was composed of a 45 mm diameter and 85 mm height plastic cylinder column with a hole drilled at the center of the bottom surface and at a height of 30 mm from the bottom surface (Fig. 1S). Shelters of 5 m each were installed at the corners of the planar arena as an intermediate habitat. Each shelter was filled with 30 g of sawdust diet to provide feeding source to maintain the activities. Agar was injected into the top of the feeding head, just like the main nest. A flexible plastic tube was connected to the hole of the shelter to produce an artificial pathway so that the whole arena was connected as a single colony. Planar arena, which was installed as a screen to observe the movement of the subterranean termites placed inside, was modified according to the features of R. speratus based on a method reported in previous studies on C. formosanus (Su, 2005; Chouvenc et al., 2011; Chouvenc, 2018). A transparent acrylic plate of 1 mm thickness was placed between two 2 mm thick transparent acrylic plates in a sandwich format to produce a space for the termite individuals to move actively inside. The upper 2 mm acrylic plate had a hole in the corner where it met the shelter for facilitating the entry of the termites. Moreover, 30 g of silica sand (Silica sand No 7, Saeron Industry, KOR) injected with 10% distilled water was added to the inside of the planar arena. This process maintained the internal humidity so that the individuals can move actively along different shelters through the planar arena.
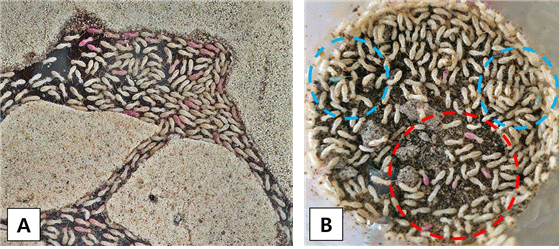
In the foraging arena, 25,000 of R. speratus colony was divided into 33 groups and placed in the main nest and shelters. After 25,000 R. speratus colony were introduced, it was monitored for 7 days to confirm the connection of the entire area. 500 individuals marked with 0.2% of Nile Blue A and Neutral Red were separated based on each color and placed in the shelters located at both ends of the planar arena (Fig. 1(A), 1(B)). Through this process, the spread area coverage of the marked individual for each day and the time taken to reach the opposite point, which was at a distance of 40 m from the input point, was measured. Five replicates were conducted to confirm the spreading tendency after Nile Blue A and Neutral Red were injected into one foraging arena.
Analysis of variance (ANOVA) was performed using the SPSS Statistics program (IBM SPSS Statistics 26, USA) on the amount of feed consumption depending on the type and concentration conditions of the dye markers and the survival rate for each condition. When ANOVA demonstrated a significant difference between the average results of each treatment, different letters (a-e) were used for marking. For the post-hoc comparison analysis, Tukey’s honestly significant difference post-hoc test was conducted. The results of the analysis are presented along with standard deviation (±).
3. RESULTS and DISCUSSION
Nile Blue A and Neutral Red were used at concentrations of 0.1%, 0.2%, and 0.5% to stain the termites for 5 days. The results suggested that when compared with the control group, it was possible to visually distinguish the marked individuals with naked eyes even when only 0.1% of both dyes were used (Fig. 3). This result is probably due to the accumulation of the fed dye markers within the trophocytes, the cells present in the fat bodies of the termites (Evans, 1997).

Very few unstained individuals were found during the 5 days of the staining period, which is thought to be caused by the pre-molting fasting or physiological reasons (Su et al., 1983).
Meanwhile, in all conditions, every soldier was marked by the transfer effect from the workers at the end of the 5 days of the staining period (Fig. 4). Just like the workers, the soldiers also demonstrated deeper marker color as the concentration increased since the workers transferred the marking reagent along with the other nutrients through the trophallaxis. Also, such a result is consistent with those from previous studies investigating the appropriate concentration of Nile Blue A on various species such as R. speratus, Coptotermes frenchi, C. lacteus, Nasutitermes exitiosus (Evans, 1997; Kim et al., 2020).

Even under the forced feeding (no-choice) condition, as the concentration of Nile Blue A and Neutral Red increased, feed consumption decreased depending on the concentration compared to the control group by 76%~88% in the 0.1% concentration condition, 46%~61% in the 0.2% concentration condition, and 18~29% in the 0.5% concentration condition (Fig. 5). Additionally, ANOVA showed that there was a difference in the amount of feed consumption between the control group and each concentration condition. These results suggest that both dyes, irrelevant of the type, had adverse effects on feed consumption depending on the concentration of the dye.
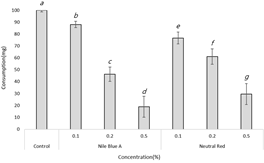
This trend is consistent with the findings of Im and Han (2020), which demonstrated a reduction in the feed consumption of R. speratus as the Sudan Red 7B concentration increased. Furthermore, similar results have been obtained in previous studies when various dye markers such as Nile Blue A, Neutral Red, Sudan Red 7B, and Sudan Blue 35 were applied to R. flavipes (Atkinson, 2004; Grace and Abdallay, 1989, 1999).
In this regard, Delaplane et al. (1988) stated that as the concentration of the marking reagents increases, their uptake comparatively rises for the same amount of feed, which causes a reduction in the intestinal protozoa and impacts the digestion efficiency negatively. Also, Grace and Abdallay (1989) stated that such a reduction in feed consumption depending on the concentration could be caused by the sublethal physiological effect and not by the behavioral avoidance of the marking reagents.
Therefore, this trend of decreased feed consumption according to the concentration increase appeared to be caused by sublethal physiological effects, such as the reduced number of intestinal protozoa, and further studies are needed to measure the changes in the number of intestinal protozoa right after the marking of the R. speratus for each concentration condition.
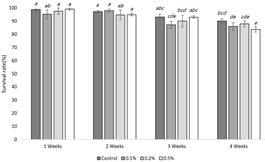
The survival rate of the termites for 4 weeks after the forced feeding of the marking reagents containing different concentrations of Nile Blue A and Neutral Red was investigated (Fig. 6, 7).
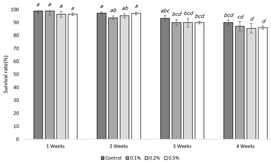
[TG_FP]For Nile Blue A, all concentration conditions showed approximately 90% survival rate until week 3. and approximately 85% until week 4 (Fig. 6). The result from ANOVA on the survival rate of the control group and all the other treatment groups for each week indicated that the significance level was < 0.05 (P > 0.05), which confirmed that there was no difference in the survival rate for all the groups. This result is also consistent with the study by Nobre (2007), which found that the survival rate of R. grassei when 0.2% and 0.5% of Nile Blue A were applied was maintained at 90%, with no difference from the control group.
For Neutral Red treatment, the control group and all 0.1%–0.5% treatment groups demonstrated approximately 90% survival until week 3 (Fig. 7). However, 0.5% concentration condition decreased the survival rate to 84% after week 4, which confirmed the presence of a difference between the control and treatment groups in the survival rate as per ANOVA (Fig. 7). Therefore, the application of 0.2% Neutral Red to R. speratus is considered appropriate.
According to the study by Nobre et al. (2007), the mortality rate of Neutral Red 0.5% stained R. grassei was approximately 35%, which is three times higher than that of the control group. This mortality rate is much higher than that observed in the present study (about 16%), and this difference could be due to the variation in the feeding sources during the 4 weeks of incubation after the staining. During the study by Nobre et al. (2007), nutritional deficiencies could have been caused in the termites as they were provided with only filter papers for 3 weeks; however, the termites were fed with a sawdust diet in the present study.
Additionally, when Im and Han (2020) applied Sudan Red 7B to R. speratus in the same environmental condition, the difference in survival rate of the control and treatment groups was clear after 10 days of staining. The survival rate of the treatment group was < 85%, which is a limitation of the application of this dye. However, except for 0.5% Neutral Red, both dyes did not cause any difference in the survival rate between the groups, and a survival rate of > 90% was maintained even after 4 weeks. In conclusion, it was confirmed that Nile Blue A and Neutral Red do not affect the survival rate of R. speratus and could serve as appropriate dye markers for staining the subject.
After staining R. speratus for 5 days with Nile Blue A and Neutral Red at each concentration condition (0.1%, 0.2%, and 0.5%), marking was persistently measured for 11 weeks while feeding Sawdust diet. Both Nile Blue A and Neutral Red exhibited a deeper color of marking as the concentration increased with visual observation over time. Additionally, none of the marked individuals in any of the conditions exhibited any signs of fading after week 4 (Fig. 8). However, after week 8, some of the individuals stained with 0.1% of the dye retained the marking (Fig. 8(G)), while the marking of other individuals faded. This finding is consistent with previous studies stating that when R. flavipes and R. virginicus were stained with 0.1% Nile Blue A for 3 days and fed with a mixed-wood diet for 27 days (approximately 4 weeks), the marking faded and the marked individuals were measured as unmarked ones (Thorne et al., 1996). However, there was a difference in the fading time between the previous study and this one. In this study, the marking reagents were fed for 5 days, which resulted in a comparatively larger amount of the reagent to be accumulated in the body. Hence, even when stained with 0.1% of the dye, fading occurred only at 8 weeks, which is twice as long as the 4 weeks reported in the previous study.
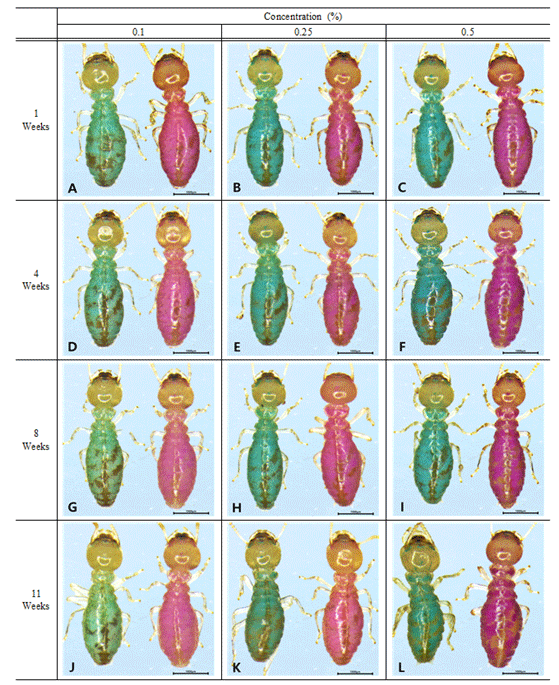
Meanwhile, at all concentration conditions > 0.2% of Nile Blue A and Neutral Red, no sign of fading was observed in any of the marked individuals after week 11, and the marking was clearly persistent (Fig. 8). When compared with the study by Im and Han (2020) that showed 1 week (7 days) marking persistence of the 2% Sudan Red 7B, which was the highest concentration condition applied, this result demonstrated 11 times longer durability of the marking reagents. Therefore, the application of Nile Blue A and Neutral Red at 0.2% and 0.5% concentration conditions on R. speratus is suitable for the visual observation monitoring for the range of the subterranean termite colony areas. Thus, it is possible to apply the mark-release-recapture (MRR) method for monitoring via monitoring device round wooden structures.
Transfer effect through nutrient exchange between the marked and unmarked individuals in the same colony was measured (Table 1). Since there was no increase in the number of individuals stained with Nile Blue A and Neutral Red for 21 days, there was no transfer effect through trophallaxis. Furthermore, soldiers placed together did not exhibit any transfer effect. Similar results have been reported in a study by Evans (1997), which stated that once the marking reagents are accumulated in the lipids, transfer effect does not occur through trophallaxis.
Meanwhile, Nile Blue A and Neutral Red markings were retained by the individuals even after molting (Fig. 9). Since the fed marking reagents were dissolved in lipids that constituted the fat body of the termites (Evans, 1997), marking did not fade even after molting. In conclusion, while marking R. speratus with Nile Blue A and Neutral Red, the workers can transfer the marking reagent via nutrient exchange to soldiers. However, when the dyed workers are placed in the colony with soldiers, there is no transfer effect through nutrient exchange between the workers and soldiers.
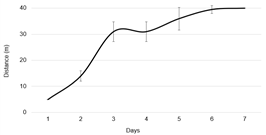
Five hundred marked individuals were placed in a planar arena with an R. speratus colony of approximately 25,000 termites to investigate the speed and area of spread of the marked ones (Fig. 10, 11). It was observed that the marked individuals moved a distance of up to 5 m within a day. Within 2 - 3 days, these individuals spread over a relatively wide range of up to 25–30 m, and a mixture of Nile Blue A and Neutral Red stained individuals released from each end was detected (Fig. 11(B)). After 6 days, the spread area of the marked individuals was 35 - 40 m, which is the whole area of the arena.
Restricted laboratory conditions with limited foraging arena space and containing a colony of approximately 25,000 R. speratus are different from the natural conditions of the R. speratus colony in terms of the number of colony members and the size of the habitat. Also, careful interpretation of this study results should be made since the length was measured in one-dimensional plane space. In contrast, the natural condition occurs in a three-dimensional range of area. The subterranean termites move around in the range of the colony area by tunneling in nature, and this study too observed the pattern of spread of the marked individuals through the tube connected to the planar arena over time. Thus, it could be concluded that the result of this study is not significantly different from the activity patterns of termites in their natural habitat.
Tusunoda (1999) reported that in nature, the R. speratus colony has an area range of approximately 10 m in a linear distance. However, previous studies (Paulmier et al., 1997; Grace et al., 1989; Grace, 1990; Su, 1993; Vargo, 2006) on Reticulitermes spp. other than R. speratus measured the foraging distance of colonies using dye markers in the field, and the reported linear distance varied from 30 to 122 m, depending on the size and species of the colony (Table 2). According to such results, it is most likely that the linear distance of the extent of the activity area for R. speratus colony in nature is > 10 m.
| Species | Foraging Populations | Foraging Distance | Journal |
|---|---|---|---|
| R. flavipes | - | 23.5m | Vargo, 2003 |
| - | 30m | Vargo and Carlson 2006 | |
| 720,000 ~ 940,000 | 41m | Grace, 1990 | |
| 20,000 ~ 5,000,000 | 71m | Su et al., 1993 | |
| 1,761,170 ~ 2,407,268 | 48m | Grace et al., 1989 | |
| 2,581,197 ~ 3,793,879 | 79m | ||
| R. hageni | - | 30m | Vargo and Carlson 2006 |
| R. santonensis | 1.070.000 ~ 1,330,000 | 65m | Paulmier et al., 1997 |
| 216,000 ~ 244,000 | 40m | ||
| R. speratus | - | 5m | Nakajima and Mori, 1961 |
| 109,400 ~ 466,400 | 10m | Tsunoda et al., 1999 | |
| R. virginicus | - | 122m |
Vargo, 2003 Vargo et al., 2006 |
4. CONCLUSION
It was confirmed that when different concentration conditions of Nile Blue A and Neutral Red are used to dye R. speratus, the amount of feed consumption decreases as the concentration increases. However, the body color is deepened since more marking reagents are accumulated in the body. Also, after assessing the survival rate, marking persistence, and transfer effect while feeding the termites with sawdust diet, 0.2% of Nile Blue A and Neutral Red appear to be appropriate for staining.
Termites stained with the two dye markers selected in this study, Nile Blue A and Neutral Red, could be clearly distinguished with visual observation. Thus, if individuals are collected from each end of the area where the subterranean termite infestation has been confirmed and marked with different dyes and released (application of MRR method) in the same way as in the foraging distance experiment of this study, it is possible to check the same colony according to the presence of the mixed marked individuals.
In the laboratory environment, the marked individuals were observed to spread to a distance of up to 40 m in 7 days. Therefore, when calculating the activity area of termites colony around the wooden structure through the monitoring device, it is necessary to observe the diffusion of marking units by recapturing them after sufficient time has elapsed after Mark-Release.