1. 서 론
생명체는 호흡을 통해 에너지를 얻는 과정에서 활 성산소를 발생시킨다. 활성산소는 외부에서 침입한 세균을 산화시켜 살균작용을 하고, 세포사이의 신호 를 전달하는 역할을 한다. 하지만 과량의 활성산소는 인체 내의 세포, 지질, DNA 및 효소에 산화적 손상 을 일으켜 치매나 각종 질병의 원인이 된다(Kumar 등, 2017). 인체는 활성산소를 제거할 수 있는 예방 체계가 존재하지만 현대인들은 스트레스와 식습관 변화, 화학물질의 이용으로 인체가 방어할 수 없는 과량의 활성산소가 체내에 생성되어 문제가 된다 (Devasagayam 등, 2004). 과량의 활성산소는 식품섭 취를 통해 제거할 수 있으며, 페놀 화합물, 비타민, 테르페노이드, 카로티노이드 등이 그 역할을 한다 (Hossain 등, 2007).
항산화제는 크게 천연 항산화제와 합성 항산화제 로 구분할 수 있다. 일반적으로 천연 항산화제는 추 출물이나 농축물의 형태로 단일 물질인 합성 항산화 제와 비교하여 낮은 활성을 나타낸다. 하지만 인체의 흡수량이 높아 합성 항산화제와 비교하여 효율적 이 용이 가능하다(Lee와 Shin, 2009). 대표적인 합성 항 산화제로는 butylated hydroxytoluene (BHT), butylated hydroxyanisole (BHA)가 있으며, 이것은 주로 식품 첨가물로 이용되고 있다(Suh와 Choi, 2010). BHT와 BHA는 저렴한 가격으로 널리 사용되고 있 지만 과량 이용시 암을 촉진시키기 때문에 식품 첨 가물 수준에서 사용을 권장하고 있다(Williams 등, 1999). 따라서 건강기능식품의 역할을 하면서 안전 성이 보장된 천연 항산화제의 개발이 요구되고 있다.
해당화(Rosa rugosa Thunb.)는 염도가 높고 바람 이 많이 부는 해안가에서 자생하는 식물로 척박한 환경에 대해 저항성을 가진다. 전통적으로 해당화 뿌 리는 당뇨병 치료에 이용되었으며, 최근 연구결과 해 당화 뿌리에서 항당뇨 활성을 보이는 triterpenoid saponin이 보고되었다(Thao 등, 2014). Methanol을 이용한 해당화 추출 연구에서는 DPPH (2,2-diphenyl-1-picrylhydrazyl) 라디칼 소거능이 다른 염생식물(퉁 퉁마디, 갯쑥 등)과 비교하여 높다고 보고하였다(Lee 등, 2004).
현재까지 장미과에 속하는 해당화는 주로 관상용 식물로 알려져 있으며, 상업적으로는 오일과 차의 형 태로 소비되고 있다. 해당화 연구에 있어 가장 활발 하게 진행되고 있는 뿌리 추출물은 항당뇨에 높은 효과를 보이지만 뿌리를 이용할 시 일회성 작물로 소비되어 지속적인 활용이 어렵다. 따라서 본 연구에 서는 작물의 활용성을 증가시키기 위해 지속적으로 소비할 수 있는 해당화 부위(꽃, 잎, 열매)를 이용하 여 항산화 활성을 탐색하였으며, 상업적으로 이용되 는 해당화 오일 추출과정에서 생산되는 액상산물의 활용 가능성을 확인하였다.
2. 재료 및 방법
해당화(Rosa rugosa Thunb.)는 전남대학교 농장 (35°10’25.5”N 126°54’00.3”E)에서 2016년 7월에 채 취하였다. 꽃, 잎, 열매, 과육, 씨로 분리하여 4°C에 서 냉장보관 후 실험에 사용하였다. 열매는 꼭지를 제거한 후 보관하였으며, 과육은 열매를 4등분으로 절단하여 씨를 제거한 후 실험에 사용하였다.
추출 전에 실온에서 각각의 시료 300 g을 증류수 1 ℓ에 침지하여 48시간 동안 유지하였다. 부피가 큰 잎은 150 g/ℓ로 48시간 침지시킨 후 실험에 사용하 였다. 추출은 clevenger-type 장치로 상압에서 냉각수 순환장치를 이용하여 3회 이상 반복하였다. Heating mantle (MS-DM606, mtops, Seoul, Korea)에서 6시간 동안 열을 가한 후 오일을 추출하고 남은 액상을 열 수추출물로 명명하였다. 감압여과기를 이용하여 고 체 시료와 액상산물을 분리하였으며, 분리된 액상은 동결건조 후 실험 전까지 분말 상태로 보관하였으며 물에 희석한 후 분석에 사용하였다.
총 페놀성 화합물(TPC)을 측정하기 위하여 Folin-Denis 법을 사용하였다(Singleton 등, 1999). 각각의 추출물 0.2 mℓ에 Folin-Ciocalteu’s phenol reagent 1 mℓ를 혼합한 후 7.5% Na2CO3 0.8 mℓ를 첨가하였다. 실온 에서 차광상태로 2시간 동안 방치한 후 UV-vis spectrophotometer (JP/UV1800, Shimadzu, Kyoto, Japan)를 이용하여 760 nm에서 흡광도를 측정하였다. 총 페놀성 화합물 측정을 위해 vanillin을 표준물질로 사용하였다.
총 플라보노이드(TFC) 함량은 Smith 등(2015)의 방법을 변형하여 측정하였다. 추출물 0.5 mℓ에 증류 수 3.2 mℓ를 넣고 5% NaNO3 0.15 mℓ와 암반응 시 킨 후, 10% AlCl3 0.15 mℓ를 혼합하여 6분간 반응 시켰다. 이후 1 M NaOH 1 mℓ를 넣고 UV-vis spectrophotometer를 이용하여 510 nm에서 흡광도를 측 정하였다. 총 플라보노이드 함량 측정을 위해 quercetin을 표준물질로 사용하였다. 분석은 3반복하였으 며 결과는 평균값과 표준편차로 표시하였다.
DPPH 라디칼 소거능은 Brand-Williams 등(1995) 의 방법을 변형하여 측정하였다. Ethanol에 희석된 추출물 0.1 mℓ와 0.4 mM DPPH 용액 1 mℓ를 혼합 한 후 ethanol 1.4 mℓ를 첨가하여 최종부피를 2.5 mℓ로 조절하였다. 혼합물은 실온에서 차광상태로 30분간 반응시킨 다음 UV-vis spectrophotometer를 이용하여 517 nm에서 흡광도를 측정하였다. 양성 대 조군으로는 butylated hydroxytoluene (BHT)을 사용 하였다. DPPH 라디칼 소거능은 식 (1)에 의해 구하 였다.
ABTS 라디칼 소거능 측정은 Re 등(1999)의 방법 을 일부 변형하여 측정하였다. 14 mM ABTS와 4.9 mM potassium persulfate 용액을 1 : 1 (v/v)로 혼합하 여 12~16시간 동안 차광상태로 방치시켜 ABTS+를 형성시킨 후 734 nm에서 흡광도 값이 0.7~0.8이 되 도록 증류수로 희석하였다. 희석된 ABTS+용액 0.95 mℓ에 희석된 추출물 0.05 mℓ를 첨가하고 10분 후 흡광도의 변화를 측정하였다. 추출물은 0.2, 0.4, 0.6, 0.8, 1.0 mg/mℓ로 정량하여 실험에 사용하였다. 양 성 대조군은 BHT를 사용하였고, ABTS 라디칼 소거 능은 식 (1)에 의해 계산하였다. 분석은 3반복 하였 으며 결과는 평균값과 표준편차로 표시하였다.
As : 추출물 첨가군의 흡광도
Ac : 추출물 무 첨가군의 흡광도
추출성분을 확인하기 위해 HPLC (e2695, Waters, MA, USA) 분석을 실시하였다. 당 분석은 Aminex 87H column (300 × 7.8 mm, Bio-Rad, CA, USA)과 Refractive index detector (2414, Waters, MA, USA) 를 사용하였고, 이동상으로는 5 mM 황산을 flow rate 0.6 mℓ/min으로 분석하였다. 유기산은 C18 column (250 × 4.6 mm, Waters, MA, USA)을 이용하였 으며 UV-vis detector (2489, Waters, MA, USA)를 사용하였다. 이동상은 30% methanol (0.1% phosphoric acid, w/w)을 사용하고, Flow rate 1 mℓ/min 으로 분석하였다. 분석용 시료는 0.45 μm filter를 통 과시켜 여과 후 분석하였다. 분석은 3반복 하였으며 결과는 평균값과 표준편차로 표시하였다.
해당화 열수추출물에서 부위별 항산화 활성이 높 았던 추출물(꽃, 잎, 열매)의 항산화 활성 관련 물질 을 확인하기 위하여 open column chromatography를 실시하였다. 추출물에 ethanol을 첨가하여 당을 분리 하였다. 이 과정을 5회 반복하여 당 제거 후 액상시 료는 감압 농축하여 사용하였다. Glass column (26 × 500 mm)에 silica gel 60 (particle size 0.040~0.063 mm, Merck, Darmstadt, Germany)을 충진하였다. 실 험은 Kim 등(2008)의 방법을 변형하여 chloroform과 methanol을 혼합시켜 stepwise 방식으로 전개시켰다. 시간에 따라 용출되는 추출물을 test tube에 10 mℓ씩 수집하였다.
수집된 분획물을 분리하기 위하여 thin layer chromatography (TLC)와 UV-vis spectrophotometer를 사 용하였다. TLC는 silica gel 60 F254 plates (Merck, Darmstadt, Germany)를 이용하여 chloroform : acetonitrile : methanol을 1 : 15 : 4 비율로 혼합시킨 용매로 전개시켰다. 흡광도는 190 nm부터 800 nm까지 측정 하였으며, UV spectrophotometer와 TLC plate를 이 용한 각각의 분획물의 Rf 값을 비교하여 구분하였다 (A-F). 분획물의 총 페놀성 화합물, 총 플라보노이드 함량과 DPPH 라디칼 소거능은 2.2, 2.3항과 동일한 방법으로 측정하였다.
3. 결과 및 고찰
페놀성 화합물은 식물이 스스로 보호하고 번식하 기 위한 목적(햇빛, 곤충, 동물 등)으로 생성되는 2차 대사산물로 기본 골격은 aromatic ring 구조에 하이 드록실기(-OH)를 포함하는 것으로 알려져 있다 (Kähkönen 등, 1999; Chen 등, 1996). 페놀성 화합물 의 하이드록실기의 역할은 생체 내의 활성산소를 포 착하여 라디칼을 제거할 수 있으며, 페놀성 화합물 구조와 하이드록실기 위치에 따라 항산화 활성의 차 이가 난다(Rice-Evan 등, 1996). 지금까지 밝혀진 페 놀성 화합물의 효과는 항산화 및 항암작용뿐 아니라 심혈관 질환을 예방하는 등 다양한 생리활성기능을 가지는 것으로 보고되었다(Koo 등, 2016; Valko 등, 2007).
본 실험을 통해 생리활성물질의 유래가 되는 페놀 성 물질을 해당화의 각 부위별 열수추출물에서 확인 하였다(Table 1). 해당화 추출물의 총 페놀성 화합물 함량은 잎 107.29 mg/g, 꽃 102.70 mg/g, 과육 44.20 mg/g, 열매 32.67 mg/g, 씨 21.75 mg/g 순으로 높았 다. 해당화 부위에 따라 총 페놀성 화합물 함량의 차 이는 잎과 씨에서 약 5배로 나타났다.
해당화 잎 추출물 함량은 Kim과 Cha (2017)에 의 한 결과와 유사하며 꽃과 잎 추출물의 총 페놀성 화 합물은 100 mg/g 이상을 함유하고 있었다. 해당화에 존재하는 총 페놀성 화합물 함량은 플라보노이드보 다 부위에 따라서 2.46배에서 6.97배 정도 높게 나타 났다. 또한 Choi 등(2003)이 실험한 국내산 다류인 홍차, 한차, 녹차, 인삼차의 총 페놀성 화합물 함량은 각각 101.51, 95.81, 94.90, 28.30 μg/mg으로 해당화 잎(107.29 mg/g), 꽃(102.70 mg/g) 추출물에서 함량 은 기존 이용되는 차와 비교하여 높게 나타났다. 이 것은 연구된 다류와 비교해서 생리활성 측면에서 해 당화 잎과 꽃 추출물이 더 경쟁력 있는 것으로 판단 된다.
플라보노이드는 C6-C3-C6를 기본골격으로 하는 phytochemical로 식용 및 약용 식물에 다량 함유되어 있으며, 식물체에서 당과 결합하여 배당체 형태로 존 재한다(Urquiaga와 Leighton, 2000). 이러한 특성으 로 플라보노이드는 친수성과 지용성 성질을 모두 포 함할 수 있으며, 폴리페놀 구조에 의해 강력한 라디 칼 소거 활성을 가질 수 있다(Van Acker 등, 1996). 해당화 부위별 열수추출물에서 총 플라보노이드 함 량은 Table 1에 나타냈다.
총 플라보노이드 함량은 꽃 14.74 mg/g, 잎 24.28 mg/g, 열매 13.26 mg/g, 과육 17.96 mg/g, 씨 6.00 mg/g으로 잎 추출물에서 가장 높게 나타났으며 전반 적인 경향은 총 페놀성 화합물 함량과 유사하게 나 타났다. 씨 추출물에서 총 페놀 및 총 플라보노이드 함량이 상대적으로 낮게 나타났으며, 이것은 시료를 분쇄하지 않고 사용해 비교적 단단한 껍질에 의해 화합물 용출이 용이하지 않은 것으로 판단된다.
해당화 부위별 열수추출물에 대한 HPLC 분석 결 과는 Table 2와 같다. 추출된 당은 glucose, fructose, arabinose, xylose로 모두 환원성을 가지고 있는 환원 당이 검출되었다. 2009년 Xu의 연구에 따르면 정제 된 다당에서 항산화 활성을 확인할 수 있었으며, 당 의 함량이 항산화 활성에 일부 영향을 미칠 수 있을 것으로 판단된다(Xu 등, 2009).
유기산을 분석한 결과는 Table 3과 같다. 신체 내 에서 활성산소를 제거하는데 효과적인 ascorbic acid 는 꽃과 잎 추출물에서만 검출되었다. Ascorbic acid 는 쉽게 산화되기 때문에 고온에서 장시간 열수추출 에 의해 파괴되기 쉽다. 본 실험에서 ascorbic acid는 상대적으로 항산화 활성이 낮은 열매, 과육, 씨 추출 물에서 검출되지 않았다. Citric acid는 꽃 추출물에 서 가장 많이 검출되었다. Citric acid는 감귤류 과일 에 다량 포함되어 있는 물질로 항산화 활성을 증가 시키는 것으로 알려져 있다(De’Nobili 등, 2016). 따 라서 항산화 활성이 가장 높았던 꽃 추출물에서 가 장 많이 발견된 것으로 판단된다. Gallic acid는 주 로 꽃 추출물에서 발견되었으며, 이것은 과일에서 다량 발견되는 phenolic acid로 강력한 항산화 활성 이 있는 것으로 알려져 있다(Aruoma 등, 1993). 또 한 gallic acid는 catechin과 결합하여 강력한 항산 화 작용을 하는 epigallocatechin gallate (EGCG)가 되는 것으로 알려져 있는데, Zhang 등(2014) 연구결 과에 따르면 해당화 차 속에 EGCG가 포함되어 있는 것을 확인할 수 있다. Citric acid, malic acid, gallic acid는 꽃, 잎, 씨, 열매, 과육 추출물 순으로 함유되 어 있었으며, 이는 항산화 활성을 나타내는 DPPH, ABTS 결과와 유사하였다.
DPPH법은 다른 방법과 비교하여 상대적으로 빠 르게 항산화 활성을 평가할 수 있어 가장 널리 이용 되고 있다(Yu와 Oh, 2016). 꽃과 잎 추출물을 비교 했을 때 잎 추출물이 총 페놀과 총 플라보노이드 함 량이 많지만 꽃 추출물의 항산화 활성이 더 높게 나 타났다(Fig. 1). 이것은 추출물에 포함된 유기산이 영 향을 주었을 것으로 사료된다(Kähkönen 등, 1999). 열매와 과육, 씨 추출물을 비교했을 때 DPPH에서는 항산화 활성의 차이가 거의 없었으며 ABTS에서는 열매 추출물에서 다소 높은 결과를 나타냈다.
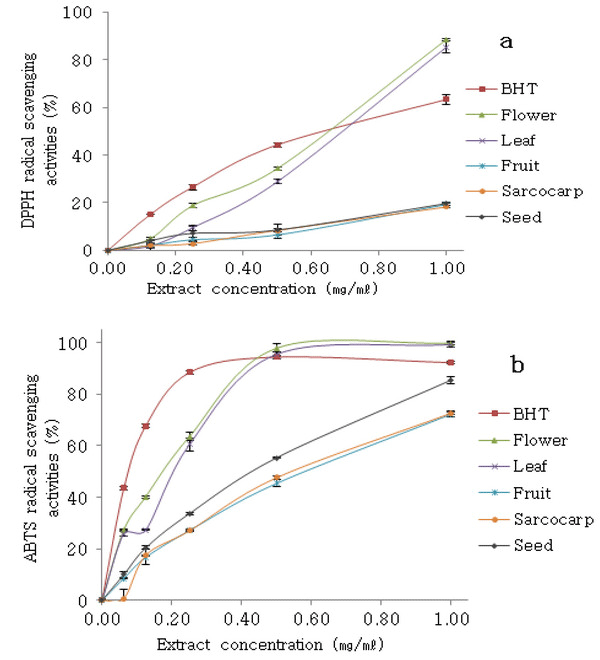
DPPH 라디칼 소거능은 Fig. 1(a)에 나타냈다. 해 당화 부위별 열수추출물들의 DPPH 라디칼 소거능은 농도 의존적으로 증가하였다. 꽃 추출물의 경우 4.90~88.55%의 소거능을 보였으며, 잎 추출물은 1.84~85.35%로 꽃과 잎의 추출물이 열매(2.07~19.24%), 과육(2.00~18.22%), 씨(4.05~19.68%) 추출물보다 높은 항산화 활성을 나타냈다. 또한 추출물의 DPPH 라디칼을 50% 억제하기 위해 요구되는 추출물의 농 도 IC50 (Inhibitory Concentration)에 대한 결과는 꽃, 잎, 씨, 열매, 과육 순으로 나타났다(Table 4).
ABTS 라디칼 소거능은 항산화 물질에 의해 강산 화제인 potassium persulfate와 ABTS의 반응으로 생 성된 양이온 라디칼이 제거되는 정도를 측정하는 방 법이다(Re 등, 1999). 이 방법은 다양한 pH에서 측정 할 수 있을 뿐만 아니라 비교적 간단하고 감도가 좋 으며 수용성 및 지용성 관련 모든 항산화 물질에 적 용이 가능한 것으로 알려졌다(Yu와 Oh, 2016).
ABTS 라디칼 소거능을 측정한 결과는 Fig. 1(b)와 같다. 추출물의 ABTS 라디칼 소거능은 농도 의존적 으로 증가하였다. 열매와 과육 추출물의 경우 DPPH 와 마찬가지로 낮은 항산화 활성을 나타냈다. 꽃에서 IC50 농도가 0.27 mg/mℓ로 가장 높은 활성을 확인하 였다.
해당화 부위별 추출물에 포함된 유효물질인 총 페 놀성 화합물, 총 플라보노이드 함량과 항산화 활성을 나타내는 DPPH, ABTS의 연관성은 Table 5와 같다. 모든 요인들은 양의 값으로 선형성을 나타내며 0.500~0.958의 상관관계를 확인할 수 있었다. 총 페 놀성 화합물과 총 플라보노이드의 상관성은 p-value < 0.01에서 0.919의 높은 연관성을 나타냈다. 총 페 놀성 화합물에 영향을 받는 항산화 활성은 각각 DPPH 0.895, ABTS 0.545로 양의 선형성을 확인하 였다. 총 플라보노이드에서는 DPPH 0.958, ABTS 0.500의 연관성으로 총 페놀성 화합물과 유사한 결 과를 나타냈다. 하지만 ABTS는 총 페놀성 화합물과 총 플라보노이드 결과에서 낮은 유의성을 나타냈다 (Tai 등, 2011). DPPH와 ABTS의 항산화 활성 사이 에서는 p-value < 0.01 수준에서 유의한 값을 나타내 며 0.649로 선형성을 확인하였다.
| TPC1) | TFC2) | DPPH3) | ABTS4) | |
|---|---|---|---|---|
| TPC | 1 | - | - | - |
| TFC | 0.919* | 1 | - | - |
| DPPH | 0.895* | 0.958* | 1 | - |
| ABTS | 0.545** | 0.500 | 0.649* | 1 |
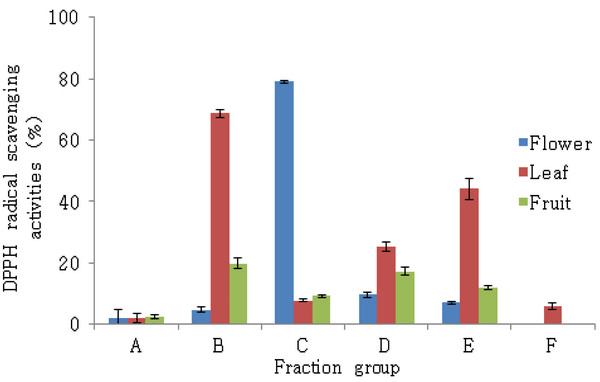
해당화 부위별 추출물을 이용하여 항산화 물질을 탐색하기 위해 과육과 씨를 포함하고 있는 열매와 꽃, 잎 추출물의 분획을 실시하였다. 과육과 씨는 열 매에서 분리된 시료로 항산화 활성의 경향이 열매와 유사하여 분획을 실시하지 않았다. Fraction group의 항산화 활성을 측정하기 위해 DPPH 라디칼 소거 능을 측정하였다(Fig. 2). Chloroform : methanol = 100 : 0의 비극성 용매로 내린 A fraction group에서 는 꽃, 잎, 열매 추출물 모두 낮은 항산화 활성을 보 였다. 그러나 극성인 methanol이 혼합되기 시작한 이 후 용출된 fraction group에서 높은 항산화 활성을 보 였다. 종합하면 꽃의 C, 잎의 B, 열매의 B fraction group에서 가장 높은 항산화 활성을 확인하였다.
가장 높은 항산화 활성을 나타낸 꽃 추출물 fraction에 대한 총 페놀성 화합물과 총 플라보노이드 함 량을 측정하였다(Table 6). Fraction C에서 각각 3305.43 μg/g, 878.42 μg/g으로 다른 fraction에 비해 높은 함량을 나타냈다. 또한 Pearson 상관분석 결과 0.996의 높은 연관성을 나타냈다(Table 7). 총 페놀 성 화합물과 DPPH radical scavenging activity는 p-value < 0.001에서 0.998의 높은 연관성을 나타냈다.
| TPC1) | TFC2) | DPPH3) | |
|---|---|---|---|
| TPC | 1 | - | - |
| TFC | 0.996*** | 1 | - |
| DPPH | 0.998*** | 0.996*** | 1 |
4. 결 론
해당화는 화장품이나 향수 오일의 원료로 상업적 으로 이용되고 있으나 오일 추출 후 대부분의 액상 산물이 버려지고 있다. 따라서 본 연구에서는 해당화 의 활용가치를 높이고자 열수추출물의 항산화 활성 을 평가하여 산업적으로 이용가능성을 확인하였다. 해당화의 부위별 열수추출물의 총 페놀성 화합물 함 량(TPC)과 총 플라보노이드 함량(TFC)을 측정한 결 과 잎에서 가장 높은 함량을 보였으나 항산화 활성 에서는 꽃, 잎, 씨, 열매, 과육 순으로 활성이 높았다. 이것은 항산화 활성에 열수추출물에 포함된 TPC, TFC 뿐만 아니라 소량의 유기산이 긍정적인 영향 을 주었을 것으로 판단된다. 또한 통계분석 결과 총 페놀성 화합물과 플라보노이드 함량이 DPPH와 p-value < 0.01 수준에서 유의한 값을 나타내며 0.895, 0.958로 선형성을 확인하였다. 항산화 물질을 탐색하기 위해 open column을 실시한 결과 극성 용 매인 methanol로 용출된 fraction group에서 높은 항 산화 활성을 나타냈다. 본 연구를 통해 해당화 열수 추출물에서 항산화 활성을 확인하였고 이를 고부가 가치산물로 활용하는데 있어 본 연구결과는 유용한 자료가 될 것이다.
